A. INDIKATOR
3.7.1 Mengimplementasikan
hukum II termodinamika dalam kehidupan sehari-hari
3.7.2 Menemukan
koherensi antara mesin pemanas carnot dengan mesin pendingin carnot
3.7.3 Menggunakan
formula besaran-besaran pada mesin carnot
B TUJUAN PEMBELAJARAN
1. Melalui
kegiatan diskusi siswa diharapkan dapat memahami hukum II termodinamika
2. Melalui
kegiatan presentasi siswa diharapkan dapat mengaplikasikan hukum II
termodinamika pada mesin carnot
3. Melalui
kegiatan latihan soal siswa diharapkan dapat menentukan nilai efisiensi pada
mesin carnot
C. MATERI AJAR
1) Peta Konsep
Gambar 3.1 Peta Konsep Pertemuan 3
2) Materi
a) Hukum
II Termodinamika
Hukum I
termodinamika menyatakan bahwa energi bersifat kekal. Energi tidak dapat
diciptakan dan tidak dapat dimusnahkan melainkan hanya dapat berubah dari satu
bentuk energi menjadi bentuk energi yang lainnya. Sedangkan mengenai perubahan
energi mana yang bisa berlangsung merupakan batasan yang akan dibahas dalam
hukum II termodinamika.
Hukum II
termodinamika menyatakan bahwa, “tidak mungkin ada proses yang menyerap
kalor dari reservoir pada satu temperatur kemudian mengubah seluruh kalor
menjadi usaha mekanis”. Pernyataan ini berarti bahwa tidak ada satu pun
mesin kalor yang benar-benar sempurna. Salah satu contohnya adalah AC. Benda
yang satu ini tidak akan mungkin mengubah kalor seluruhnya menjadi kerja, pasti
akan ada kalor yang dibuang oleh AC.
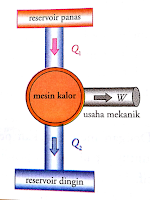
b) Mesin Kalor
Mesin kalor
adalah mesin yang mengubah sebagian panas menjadi kerja. Mesin kalor bekerja
dengan dua reservoir, yaitu reservoir suhu tinggi dan rendah. Mesin kalor
menyerap kalor dari reservoir suhu tinggi kemudian mengalirkan sebagian kalor
tersebut ke reservoir suhu rendah dan sebagiannya lagi diubah menjadi usaha
mekanik. Skema mesin kalor bisa dilihat pada gambar di bawah ini.
Gambar
3.1 Skema Mesin Kalor
Kalau ingin
mengubah nilai Q1
Efisiensi mesin
kalor yang biasa disimbolkan dengan η didefinisikan sebagai rasio antara W yang
dihasilkan dengan dengan kalor yang diberikan pada reservoir suhu tinggi Q1. Secara
matematis, dapat dirumuskan dengan,
Karena nilai usaha pada mesin kalor senilai,
Sehingga, untuk menghitung nilai efisiensi mesin kalor juga bisa dengan rumusan,
Setiap mesin
pun pasti mempunyai yang namanya koefisien kinerja. Mesin kalor yang baik
adalah mesin yang dapat menyerap banyak kalor dalam reservoir suhu tinggi dan
mengubah sebagian kalor tersebut menjadi kerja dalam jumlah yang sedikit.
Dimana, semakin besar nilai koefisien kinerjanya maka akan semakin baik pula
kinerja mesin tersebut. Untuk menentukan koefisien kinerja mesin kalor,
menggunakan rumus berikut:
Keterangan:
Kp = koefisien kinerja
c) Mesin Pendingin
Mesin pendingin
merupakan mesin kalor yang beroperasi secara terbalik. Jika mesin kalor
mengambil kalor dari reservoir suhu tinggi dan melepaskannya ke reservoir suhu
rendah, maka mesin pendingin melakukan hal yang sebaliknya, yaitu mengambil
kalor dari reservoir suhu rendah (di dalam refrigerator) dan melepaskannya ke
reservoir suhu tinggi (udara sekitar, di luar mesin pendingin).
Jika mesin
kalor menghasilkan usaha mekanik, justru mesin pendingin memerlukan usaha dari
luar untuk kelangsungan operasionalnya. Usaha luar tersebut dapat berupa energi
listrik di rumah kita. Berikut skema aliran energi sebuah mesin pendingin.
Gambar
3.3 Skema
mesin pendingin
Mesin pendingin
yang baik adalah mesin yang dapat memindahkan kalor sebanyak mungkin dari dalam
pendingin dengan usaha mekanik yang sekecil-kecilnya. Ini yang disebut dengan
koefisien kinerja, yaitu rasio antara kalor yang diserap dari reservoir suhu
rendah dengan besarnya usaha yang diperlukan. Secara matematis dapat dirumuskan
dengan,
Keterangan:
Kd = koefisien kinerja
Sehingga nilai efisiensi menjadi,
Kd = koefisien kinerja
Koefisien kinerja suatu mesin pendingin juga
bisa dicari dengan rumus,
d) Mesin Carnot
Menurut hukum
II Termodinamika, tidak ada mesin kalor yang dapat memiliki efisiensi senilai
100%. Jika kita memiliki dua reservoir suhu tinggi dan reservoir suhu rendah,
berapakah nilai efisiensi yang dimiliki? Pertanyaan inilah yang pertama kali
dijawab oleh seorang ilmuwan asal Prancis, yaitu SADI CARNOT pada tahun 1924.
Sadi Carnot mengembangkan mesin kalor dengan efisiensi maksimum yang masih
memenuhi hukum II termodinamika. Beliau memperkenalkan metode baru untuk
meningkatkan efisiensi mesin. Nama mesin tersebut adalah mesin carnot. Dan
nama siklusnya adalah siklus carnot.
e) Siklus Carnot
Siklus adalah
serangkaian proses yang dimulai dari suatu keadaan awal dan berakhir pada
keadaan yang sama dengan keadaan awalnya. Agar dapat melakukan usaha
terus-menerus, suatu sistem harus bekerja dalam satu siklus. Pada siklus
carnot terdiri atas dua proses isotermik dan dua proses adiabatik.Perhatikan
gambar berikut.
Gambar 3.4 Siklus Carnot
Proses a-b
Gas memuai
secara isotermal pada suhu Tp atau T1 (suhu
tinggi) dan menyerap kalor Qp atau Q1 (kalor
pada suhu tinggi). Pada proses ini gas menyerap kalor pada temperatur tinggi.
Suhu sistem sama dengan suhu reservoir panas, sehingga disebut proses
isotermik. Gas memuai dan melakukan usaha pada pengisap. Karena energi dalam
tetap, maka usaha yang dilakukan pada sistem sama dengan kalor yang diserap.
Proses b-c
Gas memuai
secara adiabatik sampai suhu gas turun ke Td atau T2 (suhu rendah). Pada proses ini beban pengisap
dikurangi, sehingga gas memuai menurut proses adiabatik. Terjadi pengurangan
energi dalam dan suhu sistem menurun sampai sama dengan suhu pada reservoir
dingin sambil melakukan usaha.
Proses c-d
Gas
termampatkan secara isotermal pada Td atau T2 dan mengeluarkan kalor |Qd| atau |Q2| (kalor pada suhu rendah). Gas mengalami
penyusutan dengan membuang kalor pada reservoir dingin sehingga usahanya bernilai
negatif.
Proses d-a
Gas
termampatkan secara adiabatik kembali ke keadaan awal pada suhu Tp atau T1. Beban
pengisap ditambah, sehingga gas menyusut. Pada proses ini terjadi penambahan
energi dalam dan suhu naik sampai dengan suhu pada reservoir panas. Energi dalam
gas kembali pada keadaan awal siklus.
Karena di dalam
mesin carnot adalah gas ideal, kita dapat menghitung efisiensi mesin. Karakteristik
mesin carnot dinyatakan dengan efisiensi mesin yaitu perbandingan antara usaha
yang dilakukan dengan kalor yang diserap. Secara matematis sudah diketahui pada
pembahasan mesin kalor. Namun, khusus siklus carnot! Rasio kalor di
antara dua reservoir sama dengan perbandingan suhunya. Sehingga, secara
matematis dapat dituliskan,
Sehingga nilai efisiensi menjadi,
Untuk lebih jelasnya mengenai siklus carnot,
silahkan tonton video di bawah ini:
f) Entropi
Penambahan
panas pada suatu benda akan meningkatkan ketidakteraturan pada sistem karena
akan menambah kecepatan molekul rata-rata serta keacakan gerak molekul. Contohnya
adalah ekspansi pada gas. Ekspansi pada gas juga akan menimbulkan
ketidakteraturan karena molekul akan mengalami keacakkan lebih besar setelah
mengalami ekspansi. Contoh lain adalah kristal. Sistem zat padat yang
partikel-partikelnya saling berdekatan mempunyai keteraturan yang tinggi, atau
dengan kata lain entropinya rendah.
Dengan penjelasan
di atas, dapat kita pahami bahwa entropi adalah suatu ukuran
ketidakteraturan sistem. Semakin suatu sistem tidak teratur, maka akan semakin
tinggi entropinya. Sistem pada gas yang memiliki partikel-partikel yang saling
berjauhan, pasti memiliki keteraturan yang rendah, atau dengan kata lain
tingkat entropinya tinggi.
Entropi
termasuk fungsi keadaan, sehingga harga entropi hanya dilihar dari keadaan awal
dan akhirnya saja. Tidak bergantung pada lintasan yang ditempuh. Perubahan
entropi pada suatu sistem dapat dirumuskan sebagai berikut.
Jika entropi
pada suatu sistem meningkat maka nilai
akan positif. Begitupun sebaliknya, jika
entropi pada suatu sistem menurun, maka nilai
akan negatif.













0 comments:
Posting Komentar